Bildgebung von Cilien und Centriolen unterhalb der Beugungsgrenze
Neue Anwendung der Expansionsmikroskopie mit der ZEISS Airyscan-Technologie
Primäre Cilien sind Organellen, die aus der Zelloberfläche herausragen und als „Zellantennen“ dienen, um extrazelluläre Signale zu empfangen und weiterzuleiten. Sie sind etwa 3 μm lang und haben einen Durchmesser von 0,3 μm, was unter der optischen Beugungsgrenze von Standard-Lichtmikroskopen liegt.

Der Juniorprofessor Yohei Katoh (oben rechts) und Professor Kazuhisa Nakayama (oben links) von der Fakultät für Physiologische Chemie, Universität Kyoto (Japan), haben eine neue Methode entwickelt, um die Technologien der Expansionsmikroskopie (ExM) und des Superresolutionsmikroskops ZEISS Airyscan miteinander zu kombinieren, damit sie Cilien und Centriolen mit großer Helligkeit und hoher Auflösung beobachten können. Ihre Ergebnisse wurden hier veröffentlicht.
Wir sprachen mit Dr. Katoh über die Arbeit.
Was sind die Forschungsziele Ihres Labors?
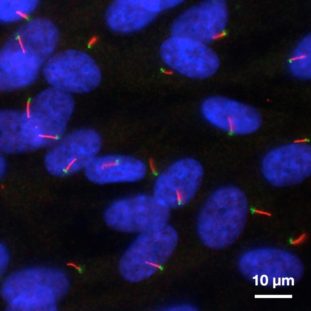
Das Nakayama-Labor konzentriert sich auf die Biogenese primärer Cilien und die Mechanismen, die der Regulierung des Proteintransportes in Cilien zugrunde liegen.
Die intraflagellären Transportmechanismen (IFT), die von Kinesin- und Dynein-Motorproteinen angetrieben werden, fördern den anterograden und retrograden Proteinaustausch. Ein umfangreicher Proteinkomplex, der fünf Multisubunits enthält, die wiederum aus insgesamt etwa 40 Untereinheiten bestehen, ist Bestandteil der Maschinerie des intraflagellären Transports. Das Nakayama-Labor hat die Struktur dieser Multisubunit-Komplexe im IFT-Mechanismus, die Rolle der einzelnen Untereinheiten in den Komplexen und die Erkennungsmechanismen der Transportproteine durch die Komplexe aufgedeckt. Dadurch konnte das Labor die molekularen Mechanismen, die der Regulierung des Transports von Ciliarproteinen zugrunde liegen, aufklären.
Defekte bei der Cilienbiogenese und beim Transport von Ciliarproteinen führen daher zu verschiedenen Erbkrankheiten mit einem breiten Spektrum an klinischen Manifestationen, im Allgemeinen „Ciliopathien“ genannt. Ziel des Nakayama-Labors ist es auch, die molekulare und zelluläre Grundlage der Ciliopathien zu verstehen.
Wie kamen Sie auf die Idee, die Expansionsmikroskopie (ExM) mit der Superauflösung durch die Airyscan-Technologie zu kombinieren?
Bevor ich diese Forschung begonnen habe, hatte ich keine Erfahrung mit superauflösenden Mikroskopen wie Airyscan oder der SIM (strukturierte Beleuchtungsmikroskopie). Da ein Superresolutionsmikroskop nicht zur üblichen Ausstattung an unserem Institut gehört, habe ich eine andere Methode der superauflösenden Bildgebung von primären Cilien gesucht.
Als ich die Arbeit zur Expansionsmikroskopie (ExM) zum ersten Mal gelesen hatte, war ich beeindruckt von der innovativen Idee, zur Expansion der Zellen superabsorbierendes Gel zu verwenden. Damals habe ich mich jedoch gefragt, ob dies wirklich möglich sei, und habe mich entschieden, diese innovative Strategie selbst auszuprobieren. Ich habe einige Reagenzien gekauft, ein paar Experimente durchgeführt und war sehr überrascht, als ich tatsächlich Zellen zum Expandieren bringen konnte.

Bei einer späteren Veranstaltung der Japanischen Gesellschaft für Biochemie in Osaka habe ich
Dr. Shuhei Chiba (Osaka City University) kennengelernt, einen erfahrenen Mikroskopiker, der zur Untersuchung von primären Cilien und Centriolen superauflösende Mikroskopie verwendet. Bei der Veranstaltung war Shuhei sehr an meinen ExM-Bildern interessiert, und wir kamen auf die Idee, die Techniken der ExM und der superauflösenden Mikroskopie miteinander zu kombinieren. Ich weiß noch, dass ich ihn in der darauffolgenden Woche mit meinen ExM-Proben in seinem Labor besucht habe.
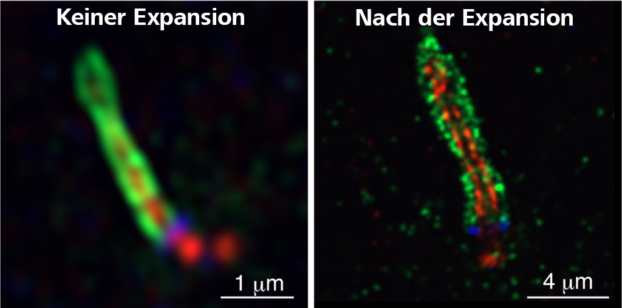
Wie haben Sie reagiert, als Sie die Daten gesehen haben?
Natürlich waren wir erstaunt über die Bildqualität. Die Centriolen, die unter einem konventionellen Mikroskop nur als Punkte sichtbar sind, erschienen beim Einsatz von ExM und Airyscan in Kombination als wunderschöne neunfach symmetrische Strukturen.
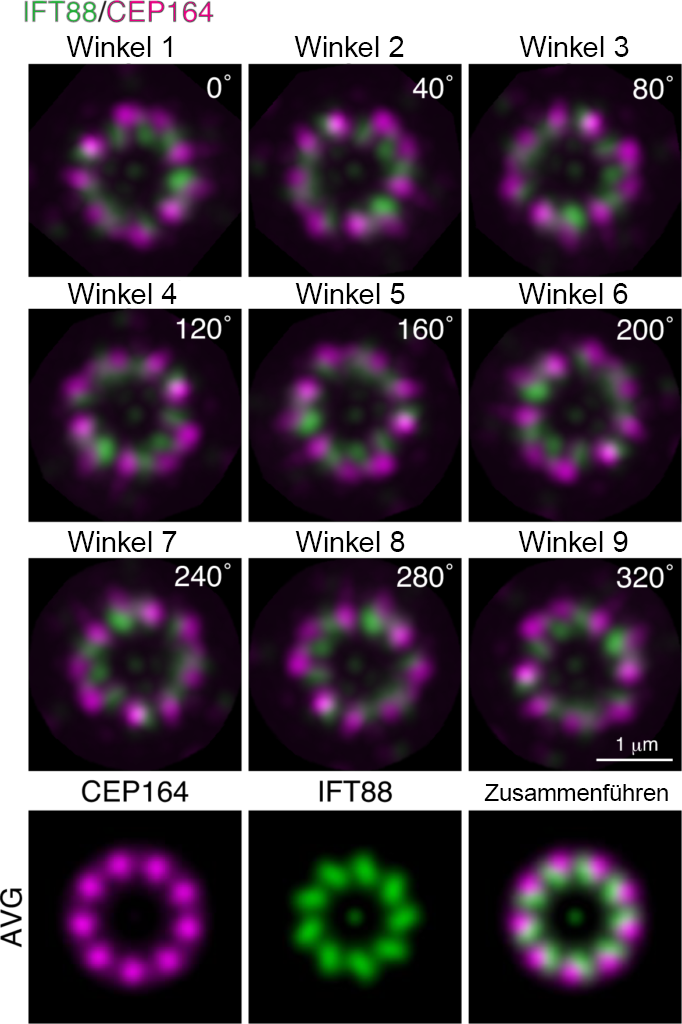
Woran wollen Sie als Nächstes arbeiten?
Der selektive Eintritt und Austritt von Proteinen in und aus Cilien wird von der Übergangszone gesteuert, die sich an der Basis der Cilien befindet. Die Übergangszone besteht aus mehr als 20 verschiedenen Proteinen, deren Mutationen Ciliopathien mit einem breiten Spektrum an klinischen Manifestationen verursachen. Jedoch ist nur wenig darüber bekannt, wie die Übergangszone durch ihre Proteine aufgebaut ist, und wie sie den Übergang der Ciliarproteine steuert. Weil die feine Struktur der Übergangszone nur beschränkt mit Standard-Lichtmikroskopie beobachtet werden kann, verwenden wir ExM und Airyscan, um die Übergangszone zu beobachten und die molekularen Mechanismen zu erklären, die dem selektiven Eintritt und Austritt von Ciliarproteinen zugrunde liegen.
Posted on December 9, 2020 @ 4:14 pm In Nutzerbericht | No Comments
Neue Anwendung der Expansionsmikroskopie mit der ZEISS Airyscan-Technologie
Primäre Cilien sind Organellen, die aus der Zelloberfläche herausragen und als „Zellantennen“ dienen, um extrazelluläre Signale zu empfangen und weiterzuleiten. Sie sind etwa 3 μm lang und haben einen Durchmesser von 0,3 μm, was unter der optischen Beugungsgrenze von Standard-Lichtmikroskopen liegt.

Der Juniorprofessor Yohei Katoh (oben rechts) und Professor Kazuhisa Nakayama (oben links) von der Fakultät für Physiologische Chemie [1], Universität Kyoto (Japan), haben eine neue Methode entwickelt, um die Technologien der Expansionsmikroskopie (ExM) und des Superresolutionsmikroskops ZEISS Airyscan [2] miteinander zu kombinieren, damit sie Cilien und Centriolen mit großer Helligkeit und hoher Auflösung beobachten können. Ihre Ergebnisse wurden hier [3] veröffentlicht.
Wir sprachen mit Dr. Katoh über die Arbeit.
Was sind die Forschungsziele Ihres Labors?

Das Nakayama-Labor konzentriert sich auf die Biogenese primärer Cilien und die Mechanismen, die der Regulierung des Proteintransportes in Cilien zugrunde liegen.
Die intraflagellären Transportmechanismen (IFT), die von Kinesin- und Dynein-Motorproteinen angetrieben werden, fördern den anterograden und retrograden Proteinaustausch. Ein umfangreicher Proteinkomplex, der fünf Multisubunits enthält, die wiederum aus insgesamt etwa 40 Untereinheiten bestehen, ist Bestandteil der Maschinerie des intraflagellären Transports. Das Nakayama-Labor hat die Struktur dieser Multisubunit-Komplexe im IFT-Mechanismus, die Rolle der einzelnen Untereinheiten in den Komplexen und die Erkennungsmechanismen der Transportproteine durch die Komplexe aufgedeckt. Dadurch konnte das Labor die molekularen Mechanismen, die der Regulierung des Transports von Ciliarproteinen zugrunde liegen, aufklären.
Defekte bei der Cilienbiogenese und beim Transport von Ciliarproteinen führen daher zu verschiedenen Erbkrankheiten mit einem breiten Spektrum an klinischen Manifestationen, im Allgemeinen „Ciliopathien“ genannt. Ziel des Nakayama-Labors ist es auch, die molekulare und zelluläre Grundlage der Ciliopathien zu verstehen.
Wie kamen Sie auf die Idee, die Expansionsmikroskopie (ExM) mit der Superauflösung durch die Airyscan-Technologie zu kombinieren?
Bevor ich diese Forschung begonnen habe, hatte ich keine Erfahrung mit superauflösenden Mikroskopen wie Airyscan [2] oder der SIM (strukturierte Beleuchtungsmikroskopie) [4]. Da ein Superresolutionsmikroskop nicht zur üblichen Ausstattung an unserem Institut gehört, habe ich eine andere Methode der superauflösenden Bildgebung von primären Cilien gesucht.
Als ich die Arbeit zur Expansionsmikroskopie (ExM) [5] zum ersten Mal gelesen hatte, war ich beeindruckt von der innovativen Idee, zur Expansion der Zellen superabsorbierendes Gel zu verwenden. Damals habe ich mich jedoch gefragt, ob dies wirklich möglich sei, und habe mich entschieden, diese innovative Strategie selbst auszuprobieren. Ich habe einige Reagenzien gekauft, ein paar Experimente durchgeführt und war sehr überrascht, als ich tatsächlich Zellen zum Expandieren bringen konnte.

Bei einer späteren Veranstaltung der Japanischen Gesellschaft für Biochemie in Osaka habe ich
Dr. Shuhei Chiba (Osaka City University) kennengelernt, einen erfahrenen Mikroskopiker, der zur Untersuchung von primären Cilien und Centriolen superauflösende Mikroskopie verwendet. Bei der Veranstaltung war Shuhei sehr an meinen ExM-Bildern interessiert, und wir kamen auf die Idee, die Techniken der ExM und der superauflösenden Mikroskopie miteinander zu kombinieren. Ich weiß noch, dass ich ihn in der darauffolgenden Woche mit meinen ExM-Proben in seinem Labor besucht habe.

Wie haben Sie reagiert, als Sie die Daten gesehen haben?
Natürlich waren wir erstaunt über die Bildqualität. Die Centriolen, die unter einem konventionellen Mikroskop nur als Punkte sichtbar sind, erschienen beim Einsatz von ExM und Airyscan in Kombination als wunderschöne neunfach symmetrische Strukturen.

Woran wollen Sie als Nächstes arbeiten?
Der selektive Eintritt und Austritt von Proteinen in und aus Cilien wird von der Übergangszone gesteuert, die sich an der Basis der Cilien befindet. Die Übergangszone besteht aus mehr als 20 verschiedenen Proteinen, deren Mutationen Ciliopathien mit einem breiten Spektrum an klinischen Manifestationen verursachen. Jedoch ist nur wenig darüber bekannt, wie die Übergangszone durch ihre Proteine aufgebaut ist, und wie sie den Übergang der Ciliarproteine steuert. Weil die feine Struktur der Übergangszone nur beschränkt mit Standard-Lichtmikroskopie beobachtet werden kann, verwenden wir ExM und Airyscan, um die Übergangszone zu beobachten und die molekularen Mechanismen zu erklären, die dem selektiven Eintritt und Austritt von Ciliarproteinen zugrunde liegen.
Article printed from Mikroskopie News Blog: https://blogs.zeiss.com/microscopy/news/de
URL to article: https://blogs.zeiss.com/microscopy/news/de/superresolution-cilien-centriolen/
URLs in this post:
[1] Fakultät für Physiologische Chemie: https://www.pharm.kyoto-u.ac.jp/physchem/index_e.html
[2] ZEISS Airyscan: http://www.zeiss.com/airyscan
[3] hier: https://www.molbiolcell.org/doi/full/10.1091/mbc.E20-04-0250
[4] SIM (strukturierte Beleuchtungsmikroskopie): http://www.zeiss.com/elyra
[5] Arbeit zur Expansionsmikroskopie (ExM): https://science.sciencemag.org/content/347/6221/543.long
Click here to print.